O letrozol é um inibidor não esteroidal da aromatase que causa bloqueio da síntese de estrogênio em mulheres após a menopausa. Dentre as principais utilizações da medicação está o tratamento de câncer de mama com expressão de receptores hormonais, assim como o tratamento do carcinoma ductal in situ e a prevenção medicamentosa do câncer de mama, em mulheres pós menopausa (1).
A dose recomendada é de 2,5 mg diários, o que confere níveis muito baixos de estrogênio sérico (2).
Mecanismo de ação
A produção de hormônio feminino em mulheres após a menopausa deve-se principalmente à ação da enzima aromatase, derivada do citocromo P450. Esta substância está presente principalmente no ovário em mulheres na pré-menopausa, mas também está presente em outros tecidos, tais como a gordura subcutânea, fígado, rins, cérebro, adrenais e músculos. Nestes outros tecidos a enzima permanece ativa mesmo após a menopausa, sendo catalisadora da produção de estrogênio (3).
Após a menopausa existe uma queda vertiginosa na produção de estrogênios pelos ovários. No entanto, as glândulas supra-renais continuam ativas na produção de androgênios, neste caso a androstenediona. A aromatase converte a androstenediona em estrona, sendo esta a principal fonte de hormônios femininos após a menopausa (3).
O processo da esteroidogênese na pós-menopausa é complexo: a aromatase catalisa a conversão de androstenediona em estrona, enquanto a esteróide sulfatase (STS) hidroliza sulfato de estrona em estrona. Posteriormente a estrona é convertida em estradiol pela 17-ß-hidroxiesteróide desidrogenase tipo 1 (17bHSD1). A testosterona, por sua vez, é convertida em estradiol pela enzima aromatase. A taxa de supressão estrogênica dos inibidores de aromatase varia de 85% a 95% (3).
Efeitos colaterais
O letrozol possui metabolização hepática, mas causa pouca agressão neste órgão. Normalmente, os níveis séricos de transaminases aumentam cerca de 1% após o início do tratamento. Existem poucos relatos de lesão celular ou colestase. A falência hepática é ainda mais rara. Todos estes efeitos costumam ser limitados e tendem a melhorar com a interrupção da terapia (3).
Os efeitos colaterais mais frequentes e que costumam causar interrupção do tratamento estão relacionados à privação extrema de estrogênio, induzindo sintomas semelhantes à síndrome climatérica severa (3).
Os problemas mais preocupantes são relacionados à saúde óssea. A privação de estrogênio aumenta significativamente a perda óssea e está relacionada a maior incidência de osteopenia e osteoporose nas usuárias de letrozol (3).
Outros efeitos colaterais comumente relatados estão mais associados à qualidade de vida, causando pouco impacto no risco de morte. Os sintomas mais relatados pelas usuárias da medicação são dores osteoarticulares e musculares, seguidos por queixas relacionadas à atrofia genital (dispareunia, perda urinária e infecções urinárias de repetição). As dores musculares e osteoarticulares podem ser amenizadas com exercícios físicos e terapias de apoio, tais como acupuntura e fisioterapia. Já os sintomas vaginais costumam ser melhorados com o uso de gel não hormonal ou laser vaginal (1) (3).
Já se acreditou que o uso continuado de letrozol poderia causar maior risco de insuficiência cardíaca, mas isto foi descartado pelas pesquisas. Outro ponto importante é que o letrozol possui menor risco tromboembólico que o tamoxifeno. Sendo assim, a medicação é normalmente a droga de escolha para pacientes com maior risco de eventos tromboembólicos (1).
Indicações
Câncer de mama
Metanálise publicada em 2022 pelo grupo EBCTCG mostrou que os inibidores de aromatase aumentam o controle local da doença em relação ao tamoxifeno, mas não mostraram melhora na sobrevida global (Figura 1) (1):
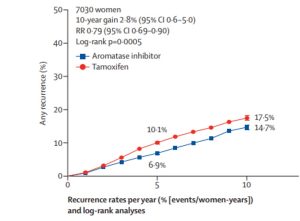
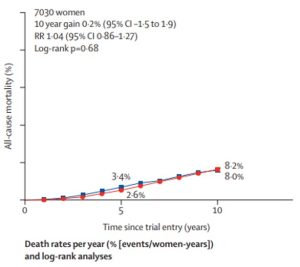
Figura 1: Comparação de estudos com tamoxifeno e inibidor de aromatase demonstrando benefício na taxa de recidivas e ausência de benefício na mortalidade (adaptado de EBCTCG, Lancet Oncol 2022; 23: 382–92) (1). (Nível de Evidência I)
Esta metanálise recebe críticas por avaliar todos os inibidores de aromatase num único grupo. O grupo Cochrane já tinha demonstrado em outra metanálise que a comparação isolada entre o letrozol e o tamoxifeno apresentou benefícios também na sobrevida global quando usado na primeira linha (Mouridsen, 2001) (4).
Indução de menopausa em tumores de alto risco
A terapia endócrina em pacientes antes da menopausa e com baixo risco de recorrência consiste na administração de tamoxifeno por 5 anos. Naquelas pacientes com risco intermediário as alternativas devem ser avaliadas caso a caso, levando em consideração os riscos, os benefícios e a posição de cada paciente. Nos casos com alto risco de recorrência e que já receberam quimioterapia adjuvante, recomenda-se bloqueio da função ovariana em associação com tamoxifeno ou inibidor de aromatase, como o letrozol (3).
A análise conjunta dos estudos SOFT e TEXT mostra vantagem para a combinação da supressão ovariana com inibidor de aromatase em relação ao tamoxifeno, sendo o subgrupo com mulheres com menos de 35 anos o que mais se beneficiou desta associação (3).
Além do uso destas medicações, as pacientes de alto risco (> 4 linfonodos positivos OU tumor maior que 5 cm com 1 – 3 linfonodos positivos OU grau 3 OU Ki-67>20%) também se beneficiam da adição de inibidor de CDK 4/6 (abemaciclibe) (3).
A duração ideal da hormonioterapia adjuvante permanece um tema indefinido tanto nas pacientes pré quanto naquelas pós-menopáusicas. Para o tamoxifeno, existem informações sugerindo que 10 anos de tratamento oferecem melhores resultados, embora os benefícios de diminuição no risco de recorrência sejam pequenos além dos primeiros 5 anos. Os IA (INIBIDORES DA AROMATASE) parecem não precisar de 10 anos de tratamento e oferecem melhores resultados nas pacientes de alto risco com 7-8 anos de administração. Já a duração ideal da supressão ovariana também permanece controversa. Os estudos SOFT e TEXT utilizaram 5 anos de bloqueio. Entretanto, estudos como o ASTRRA ou ABCSG-12 utilizaram 2-3 anos de bloqueio com resultados igualmente positivos. Dados mais recentes sugerem que em pacientes com maior risco ou aquelas com menos de 35 anos, o bloqueio ovariano mais prolongado pode estar associado a melhores resultados. Na ausência de estudos com comparações definitivas, recomendamos tratamento por 5 anos naquelas pacientes com boa tolerância aos sintomas de menopausa e naquelas com sintomatologia importante tentar levar o tratamento a pelo menos 3 anos de bloqueio (3).
A continuidade do tratamento hormonal após os primeiros 5 anos nas mulheres pré-menopáusicas permanece controversa. Nas mulheres mais jovens e de alto risco, continuar com tamoxifeno pode ser discutido, entretanto a continuidade do bloqueio ovariano por mais de 5 anos em geral não e recomendada já que não existem evidências definitivas de benefício desta estratégia (3).
Ooforectomia é sempre uma alternativa a ser discutida em situações com indicação de bloqueio da função ovariana. Esta estratégia é difícil de justificar na paciente mais jovem (neste caso com menos de 40-45 anos) onde a recuperação da função ovariana pode acontecer uma vez concluído o tratamento. Entretanto, nas pacientes com mais de 45 anos, onde a possibilidade de recuperar a função é menor e a iminência da menopausa fisiológica é algo esperado, discutir esta alternativa individualmente pode ser considerado (3).
Para as pacientes com baixo risco de recorrência, recomenda-se tamoxifeno ou inibidor de aromatase (IA) adjuvante por 5 anos.
A estratégia de switch com uso de tamoxifeno por 2 a 3 anos seguido de inibidor de aromatase (anastrozol, letrozol ou exemestano) por 2-3 anos ou a sequência reversa podem ser considerados. Vários fatores, como risco de eventos trombóticos e perda de massa óssea antes do tratamento podem interferir na escolha de qual dos esquemas é melhor para um caso específico (3).
Para aquelas pacientes de alto risco de recorrência recomenda-se acrescentar abemaciclibe ao tratamento hormonal, por até 2 anos. Nestes casos de risco elevado, a terapia endócrina deverá ser estendida para 10 anos no caso do tamoxifeno ou, preferencialmente, 7 a 8 anos com inibidores de aromatase. Se factível, aquelas pacientes de alto risco que já receberam 5 anos de tamoxifeno, podem receber 5 anos adicionais de inibidor de aromatase (3).
Após a menopausa, recomenda-se a associação de ácido zoledrônico semestral por 3 a 5 anos ao tratamento com inibidor de aromatase. Afinal estudos clínicos indicam diminuição de recorrências e aumento de 17% na sobrevida, além dos benefícios na mineralização óssea. O denosumabe apresenta os benefícios na saúde óssea, mas não tem demonstrado vantagens em termos de sobrevida e também pode ser considerado uma alternativa (3).
Prevenção medicamentosa
Em 1895 Beatson realizou a primeira ooforectomia bilateral devido a um câncer de mama localmente avançado e observou regressão de recorrência da doença em parede torácica em uma paciente na pré menopausa. A eficácia do bloqueio estrogênico para controle do câncer de mama já era conhecida desde meados do século XIX. Inúmeras drogas atuavam na supressão ovariana, estas evoluíram ao longo dos anos e o tamoxifeno (TMX) passou a ser a droga de escolha (3).
Alguns estudos sobre hormonioterapia em câncer de mama relataram redução da incidência na mama contralateral. Tais informações levaram ao primeiro estudo randomizado sobre uso de tamoxifeno na prevenção primária do câncer mamário: o NSABP-P1. Neste estudo comparou-se o uso de tamoxifeno com placebo na prevenção de câncer de mama em mulheres de alto risco ou história prévia de lesões pré-cancerígenas (hiperplasia atípica ou carcinoma lobular in situ (3).
Os resultados do estudo NSABP-P1 demonstraram redução de 49% no risco de surgimento de carcinoma mamário invasor e 50% de carcinoma in situ (Gráfico 1). Em pacientes com antecedente de hiperplasia com atipia essa redução foi de até 86%. No entanto, esta redução foi observada somente para tumores com expressão de receptores hormonais. Os tumores sem esta expressão não tiveram mudança na incidência. Consequentemente, não se observam também benefícios em mulheres com mutação genética, principalmente no BRCA-1, que normalmente têm tumores sem receptores hormonais (3).
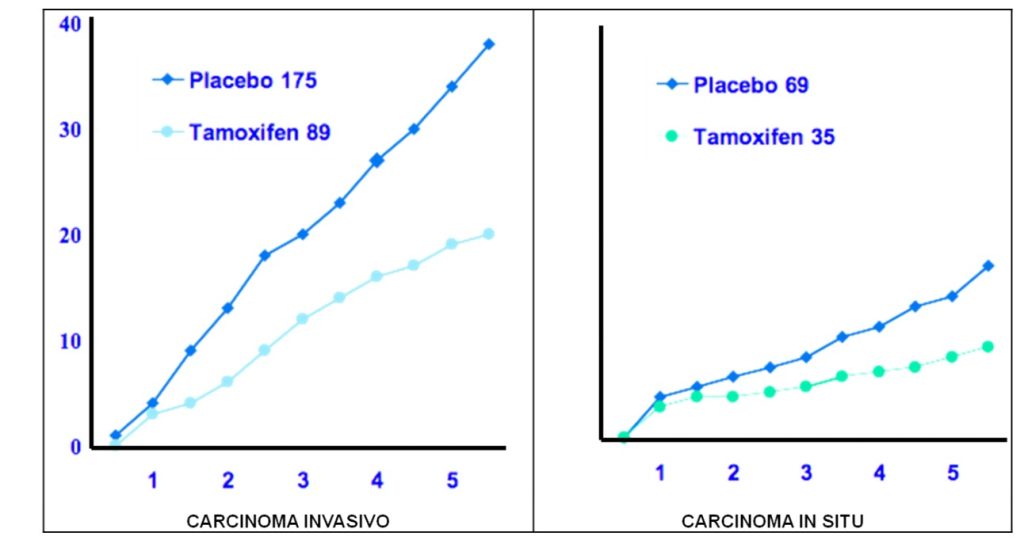
Posteriormente demonstrou-se também eficácia com o uso de raloxifeno (3).
Os estudos seguintes introduziram os inibidores de aromatase no cenário da prevenção medicamentosa do câncer de mama. Os medicamentos avaliados nos principais estudos foram o exemestano e o anastrozol, mas acredita-se que todos os inibidores de aromatase tenham efeitos semelhantes neste quesito (3).
Nas pesquisas com inibidores de aromatase também se observou redução do risco de desenvolver câncer de mama em relação ao placebo. O estudo com exemestano demonstrou diminuição em 65% no risco de desenvolver carcinoma invasor de mama (IC 95%: 0,18 – 0,70; p 0,002) e 35% no risco de desenvolver carcinoma in situ, porém sem diferença estatística neste último (IC 95%: 0,28-1,5; p 0,31) (3).
Já o estudo com anastrozol demonstrou redução de 49% no risco de desenvolver carcinoma invasor (HR 0,51, 95% IC 0,39–0,66, p<0·0001) e de 59% de carcinoma in situ (HR 0,41, 0,22–0,79, p=0·0081), especialmente tumores com expressão de receptores hormonais. Nenhuma diferença significativa em mortalidade foi observada após 131 meses de seguimento (3).
Conclui-se que a quimioprevenção com SERMs (tamoxifeno e raloxifeno) ou inibidores de aromatase são opções para mulheres com risco elevado para desenvolver câncer de mama (in situ ou invasor). A análise de que os benefícios do uso dos medicamentos superam os riscos de seus efeitos colaterais sempre deve ser considerada para a tomada de decisão, cabendo à paciente a decisão final em utilizá-los ou buscar outras formas redutoras de risco. A escolha das medicações na pós-menopausa leva em conta o risco de efeitos adversos e o letrozol é uma alternativa neste grupo de pessoas (3).
Referências bibliográficas
1. Aromatase inhibitors versus tamoxifen in premenopausal women with oestrogen receptor-positive early-stage breast cancer treated with ovarian suppression: a patient-level meta-analysis of 7030 women from four randomised trials. Early Breast Cancer Trialists’ Collaborative Group (EBCTCG)*. Lancet Oncol 2022; 23: 382–92. https://doi.org/10.1016/ S1470-2045(21)00758
2. Gibson L, Lawrence D, Dawson C, Bliss J.Aromatase inhibitors for treatment of advanced breast cancer in postmenopausal women. Cochrane Database of Systematic Reviews 2009, Issue 4. Art. No.: CD003370.DOI: 10.1002/14651858.CD003370.pub3.
3. Frasson A, Novita G, Millen E, Zerwes F et al in Doenças da Mama – Guia de Bolso Baseado em Evidências 3ª Edição, Ed. Atheneu, 2022.
4. Mouridsen H, Gershanovich M, Sun Y, Pérez-Carrión R, Boni C, Monnier A, Apffelstaedt J, Smith R, Sleeboom HP, Jänicke F, Pluzanska A, Dank M, Becquart D, Bapsy PP, Salminen E, Snyder R, Lassus M, Verbeek JA, Staffler B, Chaudri-Ross HA, Dugan M. Superior efficacy of letrozole versus tamoxifen as first-line therapy for postmenopausal women with advanced breast cancer: results of a phase III study of the International Letrozole Breast Cancer Group. J Clin Oncol. 2001 May 15;19(10):2596-606. doi: 10.1200/JCO.2001.19.10.2596. Erratum in: J Clin Oncol 2001 Jul 1;19(13):3302. PMID: 11352951.
5. Fisher B, Costantino JP, Wickerham DL, Redmond CK, Kavanah M, Cronin WM, Vogel V, Robidoux A, Dimitrov N, Atkins J, Daly M, Wieand S, Tan-Chiu E, Ford L, Wolmark N. Tamoxifen for prevention of breast cancer: report of the National Surgical Adjuvant Breast and Bowel Project P-1 Study. J Natl Cancer Inst. 1998 Sep 16;90(18):1371-88. doi: 10.1093/jnci/90.18.1371. PMID: 9747868.
Autor
Guilherme Novita – CRM-SP: 97.408
Dr. Guilherme Novita formou-se em Medicina da Universidade de São Paulo (USP) em 1999. Posteriormente, realizou 3 anos de residência médica de Ginecologia e Obstetrícia no Hospital das Clínicas da Faculdade de Medicina da USP (HCFMUSP), seguido por mais 2 anos de residência médica em Mastologia, também no HCFMUSP.
O Dr. Guilherme Novita também tem atuado na Sociedade Brasileira de Mastologia (SBM) desde 2007, ocupando cargos importantes, tais como a presidência da Comissão do Título de Especialista – TEMa (2014-2016) e Presidência da Regional São Paulo da SBM (2020-2022) e diretor geral da Escola Brasileira de Mastologia (2023-2025). Foi convidado repetidas vezes para participar dos principais congressos e simpósios sobre doenças mamárias realizados no Brasil.
Revisor
Eduardo Millen – CRM-RJ: 5263960-5
Dr. Eduardo Millen é Médico Mastologista Titular pela Sociedade Brasileira de Mastologia (SBM) tendo sido aprovado no TEMA (Título de Especialista em Mastologia) em 2001. Formou-se pela Faculdade de Medicina de Vassouras (FMV- RJ) em 1997.
Realizou residência médica de Ginecologia e Obstetrícia no Hospital do Servidor do Estado de São Paulo (IAMSPE-HSPE-SP) no período de 1998 a 2002, onde cursou o primeiro ano de residência Médica em cirurgia geral, dois anos de ginecologia e último ano, com especialização em Mastologia.
Compõe ainda a Comissão de Mastologia da Federação Brasileira de Ginecologia e Obstetrícia, além de ser autor de capítulos de livros, livros e publicações nacionais e internacionais.



